Beyond inflammation: a comprehensive microglial regulation model in chronic pain
Lei Y, Wang Q, Wang F, Mu G.
Mol Biol Rep. 2025;52(1):891. doi: 10.1007/s11033-025-11019-8.
Επιμέλεια κειμένου: Μερμίρη Μαρία, Ειδικευόμενη Αναισθησιολογίας, Πανεπιστημιακό Γενικό Νοσοκομείο Λάρισας
Ο χρόνιος πόνος αποτελεί ένα πολυδιάστατο φαινόμενο που επηρεάζει μεγάλη μερίδα του πληθυσμού και επιφέρει σημαντικό κοινωνικοοικονομικό αντίκτυπο. Σε αντίθεση με την προστατευτική δράση που ασκεί ο οξύς πόνος, ο χρόνιος πόνος συχνά αντανακλά δυσλειτουργία της νευροανολογικής πλαστικότητας. Στο επίκεντρο αυτής της διαδικασίας βρίσκονται τα μικρογλοιακά κύτταρα, οι κύριοι ανοσολογικοί ρυθμιστές του κεντρικού νευρικού συστήματος. Τα μικρογλοιακά κύτταρα συμβάλλουν στην εμφάνιση του χρόνιου πόνου μέσω τροποποίησης της συναπτικής μετάδοσης, της ουδού της νευρικής μεμβράνης και διαιωνίζοντας την ενεργοποίηση των αλγαισθητικών οδών.
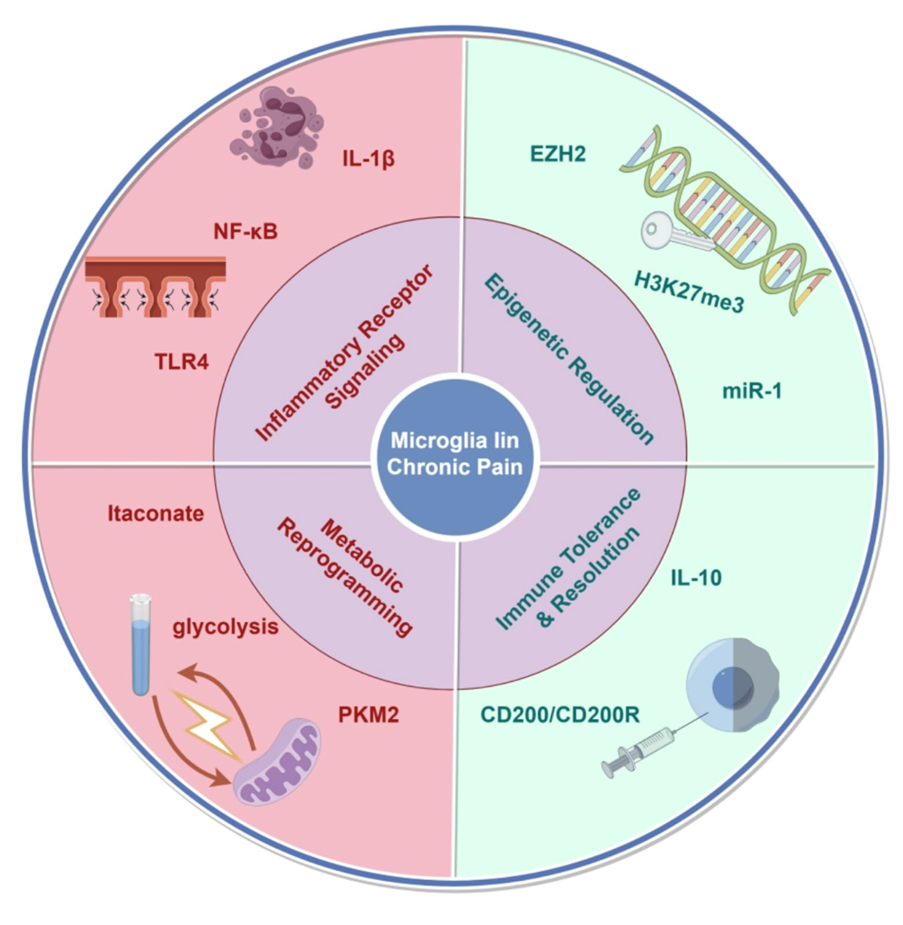
Παραδοσιακά, η έρευνα σχετικά με τον ρόλο της μικρογλοίας στον χρόνιο πόνο επικεντρωνόταν στον ρόλο της ως προφλεγμονώδους παράγοντα, μέσω υποδοχέων όπως ο TLR4, η ενεργοποίηση του οποίου προκαλεί απελευθέρωση προφλεγμονωδών κυτοκινών (IL-1β, TNF-α, IL-6) που αυξάνουν τη διεγερσιμότητα των νευρώνων και μειώνουν την νευρική μετάδοση κατά μήκος ανασταλτικών οδών. Ωστόσο, αυτό το «κλασικό» μοντέλο δεν εξηγεί επαρκώς γιατί ο πόνος μπορεί να διαιωνίζεται, ακόμα και χωρίς συνεχιζόμενη περιφερική βλάβη. Η σύγχρονη θεώρηση αναδεικνύει πιο σύνθετους μηχανισμούς που εκτός από την ενεργοποίηση φλεγμονωδών οδών, συμπεριλαμβάνουν επιγενετικές, ανοσολογικές και μεταβολικές αλλαγές.
Νέα εργαστηριακά δεδομένα επιδεικνύουν ότι οι επιγενετικές τροποποιήσεις δημιουργούν μια «μνήμη» φλεγμονής στη μικρογλοία. Μεταβολές όπως η ακετυλίωση ιστονών ή η μεθυλίωση DNA αναδιαμορφώνουν τη γονιδιακή έκφραση, ευνοώντας την παρατεταμένη προφλεγμονώδη κατάσταση. ΜικροRNA όπως το miR-124 (αντιφλεγμονώδες) και το miR-155 (προφλεγμονώδες) ρυθμίζουν δυναμικά αυτές τις διεργασίες. Επίσης, ο μεταβολικός επαναπρογραμματισμός των μικρογλοιακών κυττάρων παίζει κρίσιμο ρόλο. Ενώ σε φυσιολογικές συνθήκες η οξειδωτική φωσφορυλίωση αποτελεί την κύρια μέθοδο παραγωγής ενέργειας αυτών των κυττάρων, μετά από νευρική βλάβη στρέφονται σε γλυκολυτική λειτουργία («φαινόμενο Warburg»), παράγοντας γρήγορα ενέργεια αλλά και γαλακτικό οξύ. Το γαλακτικό οξύ, εκτός από μεταβολίτης, δρα και ως σηματοδότης που ενισχύει τη φλεγμονή και μπορεί να τροποποιήσει το γονιδίωμα, διατηρώντας και αυξάνοντας την φλεγμονώδη διεργασία . Η υπερφλεγμονώδης κατάσταση επιδεινώνεται περαιτέρω από ενεργοποίηση του συστήματος του συμπληρώματος, το οποίο συμβάλει στην καταστροφή των νευρικών κυττάρων, οδηγώντας σε συμπτώματα υπεραλγησίας.
Η συστηματική καταγραφή και κατανόηση αυτών των παθοφυσιολογικών διαταραχών της μικρογλοίας στον χρόνιο πόνο μπορεί να οδηγήσει σε νέες θεραπευτικές οδούς. Επιγενετικοί αναστολείς (π.χ. HDACi), μεταβολικοί ρυθμιστές (όπως η μετφορμίνη ή αναστολείς γλυκόλυσης) και βιολογικοί παράγοντες (IL-10 γονιδιακή θεραπεία, ανταγωνιστές TLR4, P2X7 ή CX3CR1) έχουν ήδη δοκιμαστεί σε προκλινικά μοντέλα με ενθαρρυντικά αποτελέσματα. Ωστόσο, οι αρχικές κλινικές μελέτες με χρήση της μινοκυκλίνης έχουν δείξει περιορισμένη αποτελεσματικότητα, αναδεικνύοντας την ανάγκη για περισσότερη έρευνα και εξατομικευμένη προσέγγιση.
Συμπερασματικά, ο χρόνιος πόνος συμπεριλαμβάνει διαταραχή της ρύθμισης των μικρογλοιακών κυττάρων του κεντρικού νευρικού συστήματος, προκαλώντας μια φλεγμονώδη κατάσταση η οποία επιδεινώνει και παρατείνει τα συμπτώματα του χρόνιου πόνου. Η παθοφυσιολογία αυτής της παρατεταμένης φλεγμονής περιλαμβάνει πολύπλοκες αλληλεπιδράσεις επιγενετικών, μεταβολικών και νευροανοσολογικών αξόνων που ενεργοποιούν και διαιωνίζουν τη συνεχιζόμενη καταστροφή των νευρικών κυττάρων. Η κατανόηση αυτής της δυναμικής επιτρέπει την ανάπτυξη στοχευμένων θεραπευτικών στρατηγικών, με προοπτική όχι μόνο την ανακούφιση, αλλά και την ουσιαστική τροποποίηση της πορείας του χρόνιου πόνου.